HERTONESCOBAR
05 Novembro 2014 | 07:00
A Comissão Nacional de Ética em Pesquisa (Conep) vai apresentar amanhã ao Conselho Nacional de Saúde (CNS) as propostas de três resoluções que poderão alterar significativamente a maneira como projetos de pesquisa clínica — aqueles que envolvem seres humanos — são avaliados no Brasil. O objetivo é preencher lacunas e dar mais agilidade ao sistema atual, tão moroso e burocrático que acaba por inibir a participação do país em projetos de pesquisa internacionais, além de atrasar o avanço da ciência nacional.
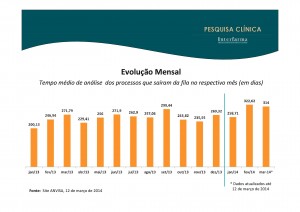
Somados todos os trâmites da Conep e da Agência Nacional de Vigilância Sanitária (Anvisa), é comum levar mais de um ano para ter um projeto de pesquisa clínica aprovado no Brail. Nos Estados Unidos e na Europa, esse prazo é de dois a três meses. “Não tem como ser competitivo dessa forma”, diz Marcelo Lima, diretor médico da Amgen, uma das várias empresas do setor farmacêutico que diz que poderia fazer mais pesquisas clínicas no Brasil, não fosse pelo excesso de burocracia. O problema afeta tanto a indústria quanto a academia.
Uma das propostas de maior impacto que deverá ser apresentada ao CNS, segundo o Estado apurou, diz respeito à distribuição de poderes entre a própria Conep e os Comitês de Ética em Pesquisa (CEPs) locais, que avaliam os projetos dentro de suas respectivas instituições (há cerca de 700 deles espalhados pelo país, ligados a hospitais, universidades e institutos de pesquisa).
No sistema atual, há uma sobreposição de competências, que obriga muitos projetos a serem avaliados duas vezes: uma pelos CEPs (de todas as instituições envolvidas na pesquisa) e outra, pela Conep. A ideia é propor um novo sistema de trâmites diferenciados, em que os comitês locais ganhariam autonomia para aprovar projetos de sua competência, de acordo com o grau de risco de cada pesquisa, e a comissão nacional só se envolveria em casos excepcionais, ou para resolver algum tipo de disputa.
“Não haverá mais dupla atribuição”, disse ao Estado o coordenador da Conep, Jorge Venâncio.
Expectativa
Pesquisadores consultados pela reportagem receberam a ideia da descentralização com otimismo. “De todas as mudanças que precisam ser feitas, essa é a mais impactante”, avalia José Nicolau, professor da Faculdade de Medicina da Universidade de São Paulo (FMUSP) e diretor da Unidade de Coronariopatia Aguda do Instituto do Coração (Incor). “Temos pessoas muito competentes nos nossos CEPs, que podem fazer uma análise tão boa quanto a da Conep, ou até melhor, num prazo muito menor.”
Segundo Venâncio, a Conep recebe cerca de 150 projetos de pesquisa clínica por mês para analisar. O prazo para a comissão dar uma resposta é de 60 dias. “Na média, temos conseguido cumprir esse prazo”, diz o coordenador.
O problema é que a primeira resposta não é necessariamente a final. Caso haja algum questionamento, o projeto é devolvido aos pesquisadores, que precisam submeter o pedido novamente à Conep, e um novo ciclo de 60 dias se inicia.
“A Conep já avançou bastante, melhorando seus processos e reduzindo o tempo das avaliações, mas ainda repete muito do esforço que é feito pelos CEPs”, diz o presidente da Associação Médica Brasileira (AMB), Florentino Cardoso, que defende também a redução da burocracia. “Não estamos pedindo facilidades; queremos apenas um sistema mais eficiente e que funcione com prazos estabelecidos. Perdemos muitos estudos por conta dessa ineficiência.”
“Isso é verdade. Vários projetos tem sido cancelados por motivos regulatórios; isto é, a demora em aprovar inviabiliza a sua realização no Brasil. Isto se deve ao descompasso com os demais tempos de aprovação em outros países. Como a maioria desses estudos multicêntricos internacionais trabalham na lógica da inclusão competitiva entre os centros, caso haja uma demora excessiva num determinado centro (ou país) o tamanho de amostra previsto é completado antes da possibilidade do projeto ser iniciado naquele centro”, explica José Roberto Goldim, chefe do Serviço de Bioética do Hospital de Clínicas de Porto Alegre.
“Os outros países, que são mais rápidos, preenchem todas as vagas da pesquisa e o Brasil fica de fora”, resume Nicolau, do Incor. (Mais informações sobre estudos perdidos abaixo.)
Cronograma
A resolução que regulamenta a análise de pesquisas clínicas pela Conep é a CNS 466, de dezembro de 2012. Os três documentos que serão apresentados amanhã são propostas de resoluções complementares à ela; não substitutivas. Além da proposta que trata da reorganização do sistema CEP/Conep, haverá uma sobre a regulamentação de pesquisas com seres humanos nas áreas das ciências humanas e sociais e outra, sobre um regime diferenciado para a análise de projetos considerados de interesse estratégico para o Sistema Único de Saúde (SUS).
“São mudanças de grande porte, por isso queremos debatê-las e corrigir eventuais problemas antes de implementar qualquer coisa”, afirma Venâncio.
As propostas passarão por uma análise preliminar do CNS e serão debatidas num encontro nacional de CEPs que ocorrerá entre os dias 17 e 19 deste mês, em Atibaia (SP). Na sequência, serão abertas para consulta pública na internet, durante três meses, e reavaliadas numa nova reunião de CEPs em abril. “Espero ter uma posição final sobre elas entre maio e junho de 2015”, calcula Venâncio.
Outra prioridade que precisará ser contemplada, segundo ele, é a modernização da Plataforma Brasil, sistema digital pelo qual são submetidos e cadastrados os projetos, que apresenta problemas frequentes. “É uma ideia fantástica, mas que carece muito de manutenção e não trouxe os benefícios que se esperava”, afirma Marcelo Lima, da Amgen.
Minoria importante
Os projetos de “pesquisa clínica” são aqueles que envolvem seres humanos; necessários, por exemplo, para testar novos medicamentos e novas práticas cirúrgicas, comparar a eficácia de diferentes tratamentos ou estudar as bases genéticas de alguma doença. A grande maioria desses projetos já é aprovada diretamente pelos CEPs locais. Apenas uma minoria — menos de 2%, segundo Venâncio — precisa passar também pela Conep, gerando o atraso da dupla análise.
O problema é que dentro dessa minoria estão muitos dos projetos considerados mais inovadores, como os que envolvem parcerias internacionais (com ou sem a participação da indústria) e o uso de novas tecnologias (incluindo novas drogas, em fase de desenvolvimento ou ainda não registradas no Brasil).
Assim, tanto pesquisadores quanto pacientes perdem a oportunidade de participar desses estudos. E a indústria farmacêutica fica limitada na sua capacidade de investir em pesquisa e desenvolvimento no Brasil.
“Muitos projetos acadêmicos sofrem repercussões negativas com este atraso, muitas vezes inviabilizando parcerias, projetos de doutorado ou pós-doutorado”, aponta Goldim, do Hospital de Clínicas de Porto Alegre. ”Um dos pontos fundamentais é discutir adequadamente a questão dos estudos com participação estrangeira. O Brasil tem que assumir o seu novo papel no cenário mundial da pesquisa científica, de um participante ativo e não mais secundário. O nosso sistema de avaliação de projetos pode servir de modelo para muitos outros países, mas ainda temos uma perspectiva de que as colaborações com o exterior devem ser avaliadas como potencialmente de risco. Ao contrário, são oportunidades de crescimento recíproco, de aprimoramento e de transferência de conhecimento e tecnologia.”
ANVISA TAMBÉM PREPARA NOVA REGULAMENTAÇÃO
Além dos trâmites da Conep, muitos projetos de pesquisa clínica— especialmente aqueles que envolvem testes clínicos de novas drogas e produtos, patrocinados pela indústria farmacêutica — precisam ser aprovados também pela Agência Nacional de Vigilância Sanitária (Anvisa), órgão responsável pelo registro e controle do uso de medicamentos no país.
Os processos correm simultaneamente nos dois órgãos, porém de forma independente. Assim, é comum pesquisadores receberem o aval de um órgão, mas terem de esperar mais alguns meses pela decisão do outro para iniciar a pesquisa.
“A demora maior é na Anvisa”, disse ao Estado Antônio Britto, presidente-executivo da Associação da Indústria Farmacêutica de Pesquisa (Interfarma). Um do problemas, segundo ele, é que a agência repete muito do esforço que já é feito pelo sistema CEP/Conep, analisando questões éticas e científicas dos projetos, em vez de se concentrar nas questões sanitárias e regulatórias relacionadas aos produtos que serão usados na pesquisa. “A primeira grande mudança necessária é a Anvisa deixar de fazer o que os CEPs e a Conep já fazem”, afirma Britto.
Segundo a assessoria de imprensa da Anvisa, o prazo para emissão de um parecer para autorização de pesquisas clínicas pela agência é de 180 dias (6 meses). Pesquisadores e empresas ouvidos pela reportagem, porém, dizem que é comum o processo demorar muito mais do que isso.
Solução proposta
Atenta às críticas, a Anvisa está preparando um novo instrumento para substituir a resolução RDC 39, de regulamenta o tema no país desde 2008, com o intuito de fazer uma “alteração radical do procedimento de análise de ensaios clínicos no Brasil”. A proposta foi aberta para consulta pública em agosto, durante 30 dias. Segundo a assessoria de imprensa da Anvisa, foram recebidas mais de 600 contribuições, que estão sendo consolidadas pelo setor jurídico da agência.
“A proposta é que uma nova norma traga melhorias no processo de autorização de ensaios clínicos com diminuições significativas nos prazos de análise sem, contudo, perda de qualidade e credibilidade da Anvisa”, diz a justificativa oficialapresentada pela agência.
Uma das mudanças propostas na consulta pública é que seja estipulado um prazo de 90 dias para que a Anvisa se pronuncie sobre um projeto de pesquisa. Sem uma resposta da agência nesse período, o projeto estaria automaticamente autorizado a começar. “Pode-se até discutir o tamanho desse prazo, mas o mais importante é que, uma vez definido, ele seja cumprido”, defende Marcelo Lima, da empresa de biotecnologia Amgen.
A previsão, segundo a assessoria de imprensa da Anvisa, é que a nova resolução seja publicada até janeiro.
“A comunidade científica está muito animada com essas iniciativas”, diz o medico e pesquisador Pedro Lemos, do Incor. “Não adianta resolver só metade do sistema; tem de resolver o binômio completo: Anvisa e Conep.”
IMPACTO DE PESQUISAS PERDIDAS É “DEVASTADOR”, DIZ CIENTISTA
A dificuldade para realizar pesquisas clínicas têm um efeito “devastador” sobre o avanço da ciência e da medicina no Brasil, segundo o médico Pedro Lemos, professor da FMUSP e diretor do Serviço de Cardiologia Intervencionista do Incor. Muitos estudos importantes deixam de ser feitos no País por causa da demora para obtenção de autorizações, segundo ele, com prejuízos significativos para os pesquisadores e para os pacientes que poderiam estar participando dessas pesquisas.
“O estímulo para fazer pesquisa clínica no Brasil é muito pequeno”, diz Lemos. “Ou você não faz, ou faz com uma morosidade enorme, ou leva a pesquisa para fora do País.” Ele compara o desafio de vencer os trâmites da Anvisa e da Conep ao de “abrir caminho num cipoal, armado apenas com uma faca de cozinha”.
Os casos mais críticos são os de estudos internacionais multicêntricos, relacionados ao desenvolvimento de novas drogas ou terapias, que trabalham com cronogramas bem definidos e precisam ser realizados simultaneamente em diversos países, com um número específico de pacientes. A burocracia nacional é tão lenta que, quando sai a autorização para iniciar a pesquisa no Brasil, muitas vezes já é tarde demais — porque a pesquisa já começou, já foi concluída, ou as “vagas” que seriam do Brasil já foram preenchidas com pacientes de outros países.
“O desestímulo é tão grande que chega ao ponto de nós mesmos recomendarmos (aos nossos colegas estrangeiros) a não inclusão do Brasil nos projetos. Imagine quão deletério é isso”, revela Lemos. “No mês passado mesmo, eu fui convidado a participar de um estudo internacional que já havia começado e falei: Nem adianta que não vai dar tempo.”
“Outras vezes o projeto nem chega para nós, porque todo mundo lá fora já sabe que demora”, diz o também cardiologista Luiz Bortolotto, diretor da Unidade Clínica de Hipertensão do Incor.
“Só neste ano já perdemos uns cinco projetos no Incor”, completa José Nicolau, diretor da Unidade de Coronariopatia Aguda. O caso mais recente, segundo ele, ocorreu na semana passada, com um estudo internacional coordenado pela Universidade Harvard, envolvendo milhares de pacientes. “Me ligaram de Harvard dizendo que o estudo já estava terminando e não dava mais para esperar o Brasil, então iam excluir a gente do projeto”, diz. “Vou falar o quê? São situações que deixam a gente muito frustrado.”
O tempo de espera para aprovação no Brasil, segundo Nicolau, é o pior da América Latina. “Nossa reputação lá fora com relação a isso é péssima”, diz. Na América do Sul, segundo a Interfarma, Argentina e Colômbia participam de mais ensaios clínicos do que o Brasil, apesar de terem uma comunidade científica muito menor.
“Qualquer estudo clínico importante elege o Brasil como uma sede de estudo, mas no final o país acaba sendo excluído por falta de agilidade burocrática”, afirma Antônio Britto, da Interfarma. “O Brasil é um desperdício de pesquisa clínica.”